Vắc xin phải thử nghiệm trên 13.000 người để trả lời câu hỏi về hiệu quả bảo vệ
Là thành viên Hội đồng đạo đức của Bộ Y tế, GS.TS Phạm Ngọc Đính là người đã tham gia các buổi bảo vệ, tranh luận thử nghiệm từ tiền lâm sàng đến lâm sàng giai đoạn 3 của vắc xin Nanocovax của Nanogen.
Ông khẳng định các thành viên hội đồng luôn đặt tôn chỉ sức khỏe cộng đồng lên đầu.
"Cá nhân tôi rất hoan nghênh những cố gắng nghiên cứu của Nanogen và các đơn vị thực hiện giai đoạn pha 3 lâm sàng của vắc xin Nanocovax. Đồng thời cũng chúc mừng thành công bước đầu của vắc xin này", GS Đính nói.
Với tư cách những nhà khoa học, Hội đồng đạo đức sẽ không cho phép bỏ qua bất cứ giai đoạn nào trong quá trình thử nghiệm vắc xin. Tuy nhiên, trong tình huống cấp bách có thể xem xét việc cấp phép khẩn cấp dựa theo đánh giá của Tổ chức Y tế Thế giới (WHO), Bộ Y tế, yêu cầu của Thủ tướng Chính phủ...
Tuy nhiên, theo ông để tiến tới có thể cấp phép có điều kiện hay cấp phép khẩn cấp bất cứ loại thuốc nào kể cả vắc xin thì đơn vị đều phải hoàn thiện đầy đủ hồ sơ đến mức độ nào đấy (theo biên bản cuộc họp của Hội đồng Đạo đức của Bộ), trình lên đầy đủ các kết quả về an toàn, về đáp ứng sinh miễn dịch và hiệu lực bảo vệ trên cộng đồng. Phải có những kết quả này thì mới được xem xét để cấp phép khẩn cấp hay có điều kiện. Bộ Y tế sẽ mời các chuyên gia tư vấn để phản biện vấn đề này.
Vắc xin Covid-19 Nanocovax.
"Theo tôi được biết cho đến giờ hồ sơ để hoàn thiện đáp ứng các yêu cầu của thử nghiệm pha 3 của giai đoạn 3 của vắc xin Nanocovax chưa hoàn thiện, chưa đầy đủ, chưa trả lời được các câu hỏi chính thức của Hội đồng khoa học, Hội đồng Đạo đức của Bộ Y tế trong cuộc họp gần đây nhất. Vì thế, trước mắt chưa thể xem xét phê duyệt khẩn cấp vắc xin Nanocovax", GS Đính lý giải.
"Chúng ta sẽ có vắc xin tốt nhất, vắc xin Covid-19 made-in Vietnam"
Tiêm vắc xin Nanocovax cho tình nguyện viên.
GS Đính cũng lưu ý là kể cả trong điều kiện nếu Hội đồng Đạo đức, Bộ Y tế chưa xem xét cấp phép khẩn cấp thì không có nghĩa là thử nghiệm này không thành công.
"Chúng ta vẫn đang đi đúng hướng, đúng quy trình. Chỉ có điều là chúng ta chờ đợi các kết quả thỏa đáng, không thể nóng vội. Có thể đưa ra dự kiến, dự thảo để trình cơ quan quản lý để cấp phép nhưng không có nghĩa là gửi thẳng đến cơ quan cấp phép mà thông qua tư vấn phản biện của Hội đồng Khoa học, Hội đồng Đạo đức", GS Đính cho biết thêm.
Ông cũng cho rằng cộng đồng nên tin tưởng vì thử nghiệm lâm sàng giai đoạn 1 đến 3 của vắc xin Nanocovax được xây dựng và thực hiện rất nghiêm túc bởi các đơn vị có nhiều kinh nghiệm, được giám sát chặt chẽ bởi cơ quan quản lý, cơ quan giám sát độc lập, các tổ chức y tế liên quan như chuyên gia của WHO…
"Tôi tin tưởng chúng ta sẽ có vắc xin tốt nhất, đáp ứng với dịch của Việt Nam và made in Vietnam. Hy vọng tháng 10 chúng ta sẽ có những lô vắc xin đầu tiên tiêm chủng cho người dân", GS Đính chia sẻ.
GS Đính cũng nhấn mạnh vắc xin vẫn phải thử nghiệm trên 13.000 người - số lượng lớn tương tự các ứng viên quốc tế, để từ đó có câu trả lời về hiệu quả bảo vệ của vắc xin.
Theo chuyên gia, kết quả ban đầu cho thấy hiệu quả sinh miễn dịch của vắc xin đáp ứng kháng thể với protein S1 đạt 99,4%. Đây là kháng thể chỉ điểm cho miễn dịch, trung hòa được virus sống. Các kết quả này cần thẩm định lại tại những cuộc họp khoa học, đánh giá nghiêm khắc.
Theo một thành viên của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc thì những vắc xin Covid-19 được Bộ Y tế cấp phép sử dụng khẩn cấp trong thời gian qua đều có kết quả thử nghiệm giai đoạn 3 trên 20.000-50.000 người. Việc cấp phép này tuân theo trình tự, phải có cơ sở dữ liệu để các chuyên gia xem xét đầu tiên là Hội đồng Đạo đức, Hội đồng Khoa học sau đó đến Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
"Nếu chỉ thử nghiệm trên 1.000 thì chưa đủ số lượng lớn để từ đó đưa vắc xin đi tiêm đại trà cho hàng triệu người", chuyện gia này nói.
Theo ông việc các bên lên kế hoạch thử nghiệm giai đoạn 3 trên 13.000 người là thấp hơn so với nhiều vắc xin khác đang được lưu hành trên thế giới. Kết quả nghiên cứu của giai đoạn 3 là quan trọng nhất để đánh giá hiệu quả bảo vệ của vắc xin, trong khi đó giai đoạn 1, 2 là để xác định tính an toàn, tính sinh miễn dịch và liều lượng tối ưu.
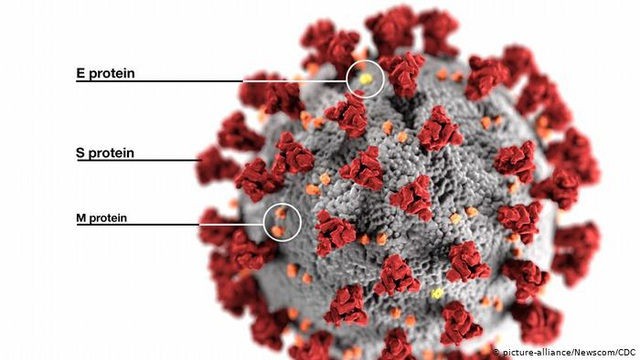
Nanogen tạo ra các gai protein (S-protein) y hệt như của virus SARS-CoV-2 để sản xuất vắc xin Nanocovax.
Bộ Y tế: Các vắc xin Covid-19 được cấp phép sử dụng khẩn cấp đều trải qua 3 giai đoạn thử nghiệm lâm sàng
Theo quy định của Tổ chức Y tế Thế giới và các nước như Mỹ, châu Âu, Nhật, Hàn Quốc…, vắc xin trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó giai đoạn 3 là giai đoạn quan trọng nhất. Cụ thể, giai đoạn này được thực hiện trên quy mô lớn với mục tiêu đánh giá tính an toàn và hiệu quả bảo vệ của vắc xin. Kết quả của giai đoạn 3 sẽ quyết định việc vắc xin đó có được phê duyệt để triển khai tiêm chủng rộng rãi hay không.
Thử nghiệm lâm sàng giai đoạn 1 và 2 được tiến hành ở quy mô nhỏ, trên một số nhóm quần thể để kiểm tra độ an toàn, tính sinh miễn dịch và xác định liều lượng tối ưu. Việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 này không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp.
Bộ Y tế khẳng định, chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vắc xin này có hiệu quả bảo vệ hay không, có làm giảm nguy cơ mắc Covid-19 hay không hoặc giảm nhẹ tình trạng bệnh hay không.
Trong bối cảnh dịch Covid-19 bùng phát rộng trên toàn thế giới, việc cấp phép khẩn cấp cho một loại vắc xin phòng Covid-19 là điều cần thiết. Tuy nhiên, theo Bộ Y tế điều này không có nghĩa là bỏ qua các giai đoạn thử nghiệm lâm sàng bắt buộc.
Việc cấp phép khẩn cấp sử dụng vắc xin Covid-19 hiện nay là do điều kiện dịch bệnh nên chưa đủ thời gian để theo dõi được vắc xin trong thời gian dài như thông lệ. Mặc dù vậy, để đảm bảo tính an toàn của vắc xin vẫn phải thực hiện đầy đủ quy trình đánh giá hiệu quả bảo vệ.
Cũng giống như thông lệ quốc tế, tất cả vắc xin Covid-19 trước khi đưa vào sử dụng khẩn cấp tại Việt Nam đều phải tuân thủ thử nghiệm lâm sàng qua 3 giai đoạn, trên nguyên tắc đảm bảo 3 yếu tố: an toàn, sinh miễn dịch và quan trọng nhất là hiệu quả bảo vệ.
Trước đó, Công ty Cổ phần Công nghệ sinh học dược Nanogen có văn bản gửi Thủ tướng về việc xin cấp phép khẩn cấp vắc xin Covid-19 Nanocovax. Cụ thể, trong văn bản, Nanogen bày tỏ mong muốn vắc xin Nanocovax sớm được cấp phép khẩn cấp có điều kiện, tương tự như các loại vắc xin của Nga, Trung Quốc và Ấn Độ.
Cần quy định chính thức, cụ thể việc cấp phép lưu hành vắc xin phòng Covid-19
Chiều 23/6, Phó Thủ tướng Vũ Đức Đam, Trưởng Ban Chỉ đạo quốc gia phòng, chống dịch Covid-19 đã chủ trì cuộc họp Thường trực Ban Chỉ đạo về công tác tiêm chủng vắc xin phòng Covid-19, thông tư hướng dẫn đăng ký, lưu hành trong trường hợp cấp bách đối với vắc xin phòng Covid-19.
Hiện nay việc cấp phép lưu hành các vắc xin phòng Covid-19 của nước ngoài tại Việt Nam đang thực hiện theo quy trình khẩn cấp. Vì vậy, Thường trực Ban Chỉ đạo nhấn mạnh sự cần thiết phải ban hành thông tư quy định chính thức, cụ thể việc cấp phép lưu hành các loại vắc xin phòng Covid-19, cả của nước ngoài và trong nước, để các hội đồng căn cứ vào đó thực hiện.
Đối với các vắc xin phòng Covid-19 nghiên cứu, phát triển trong nước, luật cũng quy định phải trải qua 3 giai đoạn thử nghiệm lâm sàng. Đại diện Bộ Y tế cho biết trong điều kiện bình thường, quy mô thử nghiệm lâm sàng các loại thuốc (bao gồm cả vắc xin) thường theo thông lệ quốc tế.
Theo quy định, thuốc phải thử lâm sàng, thuốc miễn thử lâm sàng hoặc miễn một số giai đoạn thử lâm sàng khi đăng ký lưu hành thuốc thuộc thẩm quyền của Bộ trưởng Bộ Y tế. Trong tình hình hiện nay, Bộ Y tế sẽ nghiên cứu. Trong trường hợp cần các yêu cầu, điều kiện đặc biệt mà pháp luật hiện hành chưa quy định thì Bộ Y tế sẽ trình các cơ quan thẩm quyền xem xét.
Việt Nam đã phê duyệt có điều kiện cho 4 loại vắc xin Covid-19
Đến nay, Việt Nam đã phê duyệt có điều kiện cho 4 loại vắc xin Covid-19 bao gồm: Comirnaty của Pfizer, A2D1222 của AstraZeneca, Sputnik-V của Gamaleya, Vero-Cell của Sinopharm cho nhu cầu cấp bách trong phòng chống dịch Covid-19. Ngoài ra, vắc xin Moderna cũng đang trong quá trình xem xét phê duyệt.
Theo Bộ Y tế, tất cả các vắc xin nói trên đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng. Trong đó, thử nghiệm lâm sàng giai đoạn 3 có quy mô từ 20.000 đến 50.000 người tham gia.
Cụ thể, vắc xin của AstraZeneca thử nghiệm lâm sàng giai đoạn 3 tại 11 quốc gia với 49.626 người tham gia. Vắc xin Vero-Cell của Sinopharm thử nghiệm lâm sàng tại 6 quốc gia với trên 45.000 người. Vắc xin Sputnik-V thử nghiệm lâm sàng tại 5 quốc gia với 21.977 người. Vắc xin của Pfizer thử nghiệm lâm sàng tại 6 quốc gia với 43.418 người và vắc xin của Moderna thử nghiệm tại 4 quốc gia với 30.420 người.


































