 |
Ngày 22/6, ông Hồ Nhân, Tổng giám đốc Công ty Cổ phần Công nghệ Sinh học Dược Nangogen (Công ty Nanogen), cho biết đơn vị này vừa gửi văn bản tới Thủ tướng Chính phủ, xin cấp phép khẩn cấp có điều kiện vaccine Covid-19 Nano Covax, tương tự các loại của Nga, Trung Quốc và Ấn Độ.
Tuy nhiên, ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo, Bộ Y tế, cho biết đề nghị trên rất khó được chấp thuận lúc này.
Trong cuộc họp báo vào ngày 23/6, đại diện Nanogen khẳng định: “Công ty đang làm mọi thứ đúng khoa học, không hề nóng vội trong việc xin cấp phép khẩn cấp vaccine Nano Covax lên Thủ tướng”.
Xoay quanh việc xin cấp phép khẩn Nano Covax, nhiều vấn đề đặt ra cần làm rõ.
Vấn đề 1: Nanogen có nóng vội?
Ngày 22/6, khi gửi văn bản xin cấp phép khẩn cấp có điều kiện Nano Covax, ông Hồ Nhân cho biết thêm vaccine này đã chứng minh được những thành công bước đầu, Hội đồng đạo đức trong nghiên cứu y sinh chấp thuận và đánh giá tốt. Đồng thời, Bộ Y tế và Hội đồng đã thông qua đề cương nghiên cứu, triển khai thử nghiệm lâm sàng giai đoạn 3 cho Nano Covax hàm lượng 25 mcg trên quy mô 13.000 người.
Ngay sau đó, tối cùng ngày, chia sẻ với Zing, ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo, Bộ Y tế, khẳng định: "Việc cấp phép khẩn cấp cho một loại vaccine phòng Covid-19 là điều cần thiết. Tuy nhiên, chúng ta phải dựa trên nguyên tắc đầy đủ các dữ liệu về mặt khoa học, chứng minh và trả lời được 3 câu hỏi: Có an toàn không, có sinh miễn dịch không và đặc biệt là có hiệu lực bảo vệ không?".
  |
Theo ông Quang, loại vaccine này đang còn trong quá trình nghiên cứu, thử nghiệm và chưa có dữ liệu. Kiến nghị từ Công ty Nanogen rất khó được chấp thuận bởi đây thuộc thẩm quyền chuyên môn của Bộ Y tế. Để quyết định có cấp phép khẩn cấp hay không, cơ quan này cần có các dữ liệu khoa học.
Trong bối cảnh dịch Covid-19 bùng phát rộng trên toàn thế giới, việc cấp phép khẩn cấp cho một loại vaccine phòng Covid-19 là điều cần thiết. Tuy nhiên, Bộ Y tế cho rằng điều này không có nghĩa là bỏ qua các giai đoạn thử nghiệm lâm sàng bắt buộc.
Tương tự quốc tế, tất cả vaccine Covid-19 trước khi đưa vào sử dụng khẩn cấp tại Việt Nam đều phải tuân thủ thử nghiệm lâm sàng qua 3 giai đoạn, trên nguyên tắc đảm bảo 3 yếu tố: An toàn, sinh miễn dịch và quan trọng nhất là hiệu quả bảo vệ.
 |
| Ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo, Bộ Y tế, cho rằng quyết định xin cấp phép khẩn của Nanogen còn quá sớm và nóng vội. Ảnh: Văn Nguyện. |
Vấn đề 2: Kết quả thử nghiệm lâm sàng đạt 99,4% của Nano Covax có ý nghĩa gì?
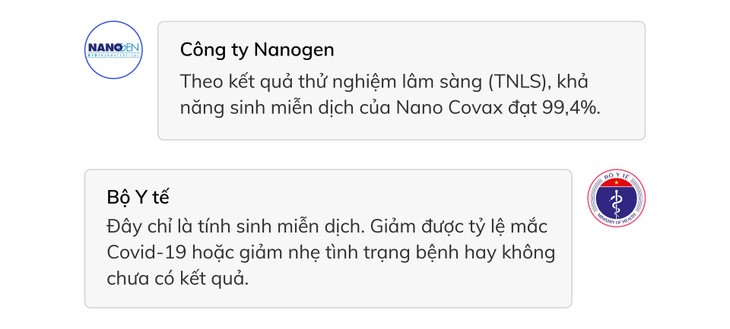
Trong cuộc họp báo ngày 23/6, đại diện Nanogen thông tin kết quả thử nghiệm lâm sàng giai đoạn 1 và 2 cho thấy độ an toàn của Nano Covax là 100% và khả năng miễn dịch là 99,4%.
Kết quả đánh giá ban đầu cho thấy vaccine Nano Covax sinh kháng thể ở tất cả tình nguyện viên tiêm vaccine. Vaccine sinh miễn dịch ở 100% người đã tiêm, tác dụng với biến thể nCoV nguồn gốc Anh và Nam Phi, trong đó Nam Phi là chủng “nguy hiểm”, có khả năng làm giảm hiệu quả của vaccine.
Tuy nhiên, ông Nguyễn Ngô Quang cho rằng đây chỉ mới là tính sinh miễn dịch. Miễn dịch này có giảm được tỷ lệ mắc Covid-19 hoặc giảm nhẹ tình trạng bệnh hay không chưa có kết quả.
  |
Theo Tổ chức Y tế Thế giới (WHO), hiệu quả của bất kỳ loại vaccine Covid-19 trong các thử nghiệm lâm sàng có ý nghĩa giúp người tiêm giảm tỷ lệ mắc bệnh. Ví dụ, một vaccine có hiệu quả 70%, nghĩa là người được tiêm chủng trong thử nghiệm lâm sàng có nguy cơ phát triển bệnh thấp hơn khoảng 2/3 so với tình nguyện viên khác không tiêm phòng.
Khi người dân ngoài cộng đồng được tiêm vaccine, WHO cho biết cơ quan y tế phải tính đến tất cả sự phức tạp của thế giới thực, không còn các điều kiện kiểm soát như trong môi trường thử nghiệm lâm sàng.
Vấn đề 3: Nano Covax an toàn?
Trong cuộc họp báo ngày 23/6, đại diện Nanogen khẳng định Nano Covax "không dùng bất kỳ thành phần sống nào của virus nên Nano Covax an toàn và không gây bất kỳ tác dụng phụ nghiêm trọng nào”.
Theo ông Nguyễn Ngô Quang, vaccine Nano Covax chọn công nghệ protein tái tổ hợp để sản xuất, là công nghệ lần đầu phát triển ở Việt Nam nên cần có thêm dữ liệu. Vị lãnh đạo này dẫn chứng vaccine AstraZeneca đã tiêm hàng triệu liều khắp thế giới nhưng vẫn có một tỷ lệ biến cố sau tiêm chủng nên người dân một số nước vẫn nghi ngại.
Đối với Sputnik V, bản chất vaccine sử dụng công nghệ vector virus, đã được hãng dược này áp dụng sản xuất từ đại dịch cúm năm 2003.
Do đó, tính an toàn, tính sinh miễn dịch cũng như hiệu lực bảo vệ đã được đánh giá qua thời gian. Khi cấp phép khẩn cấp, vaccine Sputnik V cũng đã thử nghiệm trên hàng chục nghìn người.
 |
| Dự kiến giai đoạn 3, Nano Covax thử nghiệm trên 13.000 người. Ảnh: Văn Nguyện. |
Vấn đề 4: Giai đoạn nào cấp phép là hợp lý?
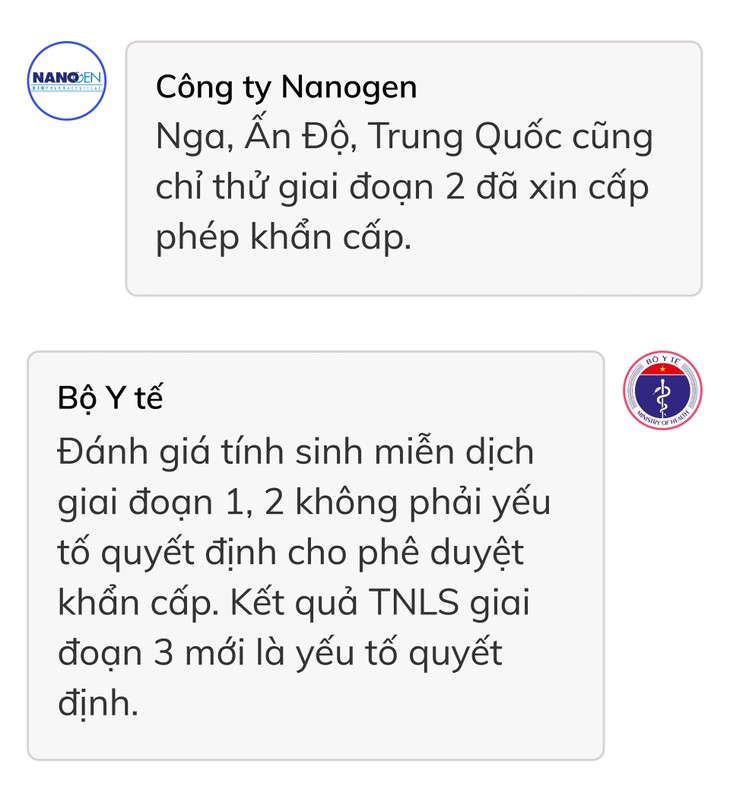
Đại diện Nanogen cho hay Nga, Ấn Độ, Trung Quốc cũng chỉ thử giai đoạn 2 đã xin cấp phép khẩn cấp.
Tuy nhiên, Bộ Y tế khẳng định việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp. Kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vaccine này có hiệu quả bảo vệ hay làm giảm nguy cơ mắc Covid-19, hoặc giảm nhẹ tình trạng bệnh hay không.
  |
Sau khi được phê duyệt, các loại vaccine đó đều phải liên tục bổ sung, cập nhật thông tin, dữ liệu liên quan tính an toàn, hiệu quả của chúng trong quá trình sử dụng. Thử nghiệm lâm sàng giai đoạn 1 và 2 được tiến hành ở quy mô nhỏ trên một số nhóm quần thể để kiểm tra độ an toàn, tính sinh miễn dịch và xác định liều lượng tối ưu.
Bộ Y tế cũng nhấn mạnh theo quy định của Tổ chức Y tế Thế giới và các nước như Mỹ, châu Âu, Nhật, Hàn Quốc…, vaccine trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó, giai đoạn 3 là giai đoạn quan trọng nhất.
Theo tài liệu Tổ chức Y tế Thế giới ban hành, quá trình sản xuất vaccine gồm 4 giai đoạn lớn. Thử nghiệm lâm sàng chỉ là một phần nhỏ trong dự án. Dựa trên quy định này, FDA của Mỹ và EMA của châu Âu (hai cơ quan chịu trách nhiệm cấp phép vaccine) cũng chia thành 4 giai đoạn khi chấp thuận các chế phẩm sinh học trong phòng ngừa Covid-19.
| Giai đoạn | Nhiệm vụ | Thời gian |
| Giai đoạn I: Phòng thí nghiệm và nghiên cứu trên động vật | - Khám phá: Xác định kháng nguyên tự nhiên có thể ngăn ngừa, điều trị bệnh. - Tiền lâm sàng: Sử dụng hệ thống nuôi cấy mô hoặc tế bào và thử nghiệm trên động vật để đánh giá tính an toàn của vaccine, khả năng tạo ra phản ứng miễn dịch. - Phê duyệt phác đồ lâm sàng: FDA và EMA sẽ phê duyệt phác đồ lâm sàng của vaccine trong 30 ngày |
1 - 2 năm |
| Giai đoạn II: Nghiên cứu lâm sàng trên người | - Giai đoạn một: Giai đoạn này đánh giá trên nhóm 20-80 tình nguyện viên; đánh giá tính sinh miễn dịch - Giai đoạn 2: Mở rộng quy mô người thử nghiệm lên khoảng vài trăm người; kiểm tra tính an toàn - Giai đoạn 3: Số lượng lên tới vài nghìn đến vài chục nghìn người; đánh giá hiệu quả của vaccine |
5 - 10 năm hoặc hơn |
| Giai đoạn III: Phê duyệt, cấp phép và sản xuất | - Nếu đủ điều kiện, loại vaccine này sẽ được phê duyệt và dán nhãn. - Sau đó, FDA hay EMA sẽ tiếp tục giám sát quá trình sản xuất vaccine: Kiểm tra cơ sở sản xuất, xem xét các thử nghiệm về hiệu lực, độ an toàn, sự tinh khiết. |
Không quy định |
| Giai đoạn IV: Kiểm soát chất lượng | Chọn ngẫu nhiên các công ty dược phẩm và tiến hành thử nghiệm vaccine sau khi chúng được sản xuất đại trà, bán ra thị trường và kiểm tra tính an toàn, hiệu quả và các tiềm năng khác. | Không quy định |
| Nguồn: WHO, FDA, EMA. |
Vấn đề 5: Số lượng người thử nghiệm lâm sàng ít?
Theo đại diện Nanogen, thử nghiệm lâm sàng của Nga, Ấn Độ, Trung Quốc chỉ trên 300, 500 người, còn Nano Covax đã thử nghiệm lâm sàng giai đoạn 3 và số lượng đến nghìn người.
Bộ Y tế cho rằng việc nghiên cứu mới chỉ ở cỡ mẫu vừa phải (mấy trăm người). Việc thử nghiệm lâm sàng một loại vaccine đòi hỏi cỡ mẫu là hàng chục nghìn người. Giai đoạn 3 thử nghiệm lâm sàng của Nano Covax mới chỉ tiêm xong mũi 1 cho 1.000 người và vẫn chưa đủ để đánh giá. Theo kế hoạch cỡ mẫu giai đoạn 3 thử nghiệm trên 13.000 người.
  |
Ngoài ra, sau tiêm thử nghiệm mũi 2 (sau 28 ngày), cơ quan chuyên môn cần phải tiếp tục đánh giá sau 36, 45, 56 ngày sau tiêm. Trên cơ sở đó, cơ quan chức năng mới đủ tiêu chuẩn đánh giá tính sinh miễn dịch và hiệu lực bảo vệ ra sao. "Như vậy, ít nhất phải sau 2 tháng và thử nghiệm trên cỡ mẫu này mới có thể đánh giá", ông Nguyễn Ngô Quang nói thêm.
Đến nay, Việt Nam đã phê duyệt có điều kiện cho 4 loại vaccine Covid-19 bao gồm: Comirnaty của Pfizer, A2D1222 của AstraZeneca, Sputnik V của Viện Gamalaya, Vero-Cell của Sinopharm cho nhu cầu cấp bách trong phòng, chống dịch. Ngoài ra, vaccine Moderna cũng đang trong quá trình xem xét phê duyệt.
Tất cả vaccine nói trên đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng. Trong đó, thử nghiệm lâm sàng giai đoạn 3 có quy mô từ 20.000 đến 50.000 người tham gia.
| Loại vaccine | Số quốc gia TNLS giai đoạn 3 | Số tình nguyện viên |
| A2D1222 (AstraZeneca) | 11 | 49.626 |
| Vero Cell (Sinopharm) | 6 | 45.000 |
| Sputnik V (Viện Gamalaya) | 5 | 21.977 |
| Comirnaty (Pfizer) | 6 | 43.418 |
| Moderna | 4 | 30.420 |
| Nguồn: Bộ Y tế. |
Bên cạnh đó, ông Nguyễn Ngô Quang nhấn mạnh quan điểm của Bộ Y tế cũng như cá nhân ông là hoàn toàn ủng hộ cho sự nghiên cứu phát triển vaccine trong nước để chủ động được nguồn cung của Việt Nam.
Tuy nhiên, trước khi một loại vaccine đưa ra tiêm rộng rãi cho người dân, chúng phải có các dữ liệu về an toàn, tính sinh miễn dịch và đặc biệt là hiệu lực bảo vệ. "Vấn đề này Bộ Y tế sẽ phải giải trình với xã hội, người dân về vaccine này có hiệu quả hay không, căn cứ vào đâu để nói là hiệu quả và tại sao đồng ý cấp phép", ông Quang nói.